高二化學知識點歸納
期末到了,高中的學生們正在緊張地復習著各個科目,其實把知識總結起來就很好復習了,那么高二化學知識點有哪些呢?今天小編在這給大家整理了高二化學知識點歸納_高二化學復習知識點,接下來隨著小編一起來看看吧!

高二化學知識點總結
1、化學反應的反應熱
(1)反應熱的概念:
當化學反應在一定的溫度下進行時,反應所釋放或吸收的熱量稱為該反應在此溫度下的熱效應,簡稱反應熱。用符號Q表示。
(2)反應熱與吸熱反應、放熱反應的關系。
Q>0時,反應為吸熱反應;Q<0時,反應為放熱反應。
(3)反應熱的測定
測定反應熱的儀器為量熱計,可測出反應前后溶液溫度的變化,根據體系的熱容可計算出反應熱,計算公式如下:
Q=-C(T2-T1)式中C表示體系的熱容,T1、T2分別表示反應前和反應后體系的溫度。實驗室經常測定中和反應的反應熱。
2、化學反應的焓變
(1)反應焓變
物質所具有的能量是物質固有的性質,可以用稱為“焓”的物理量來描述,符號為H,單位為kJ·mol-1。
反應產物的總焓與反應物的總焓之差稱為反應焓變,用ΔH表示。
(2)反應焓變ΔH與反應熱Q的關系。
對于等壓條件下進行的化學反應,若反應中物質的能量變化全部轉化為熱能,則該反應的反應熱等于反應焓變,其數學表達式為:Qp=ΔH=H(反應產物)-H(反應物)。
(3)反應焓變與吸熱反應,放熱反應的關系:
ΔH>0,反應吸收能量,為吸熱反應。
ΔH<0,反應釋放能量,為放熱反應。
(4)反應焓變與熱化學方程式:
把一個化學反應中物質的變化和反應焓變同時表示出來的化學方程式稱為熱化學方程式,如:H2(g)+
O2(g)=H2O(l);ΔH(298K)=-285.8kJ·mol-1
書寫熱化學方程式應注意以下幾點:
①化學式后面要注明物質的聚集狀態:固態(s)、液態(l)、氣態(g)、溶液(aq)。
②化學方程式后面寫上反應焓變ΔH,ΔH的單位是J·mol-1或 kJ·mol-1,且ΔH后注明反應溫度。
③熱化學方程式中物質的系數加倍,ΔH的數值也相應加倍。
3、反應焓變的計算
(1)蓋斯定律
對于一個化學反應,無論是一步完成,還是分幾步完成,其反應焓變一樣,這一規律稱為蓋斯定律。
(2)利用蓋斯定律進行反應焓變的計算。
常見題型是給出幾個熱化學方程式,合并出題目所求的熱化學方程式,根據蓋斯定律可知,該方程式的ΔH為上述各熱化學方程式的ΔH的代數和。
(3)根據標準摩爾生成焓,ΔfHmθ計算反應焓變ΔH。
對任意反應:aA+bB=cC+dD
ΔH=[cΔfHmθ(C)+dΔfHmθ(D)]-[aΔfHmθ(A)+bΔfHmθ(B)]
1、化學反應是怎樣進行的
(1)基元反應:能夠一步完成的反應稱為基元反應,大多數化學反應都是分幾步完成的。
(2)反應歷程:平時寫的化學方程式是由幾個基元反應組成的總反應。總反應中用基元反應構成的反應序列稱為反應歷程,又稱反應機理。
(3)不同反應的反應歷程不同。同一反應在不同條件下的反應歷程也可能不同,反應歷程的差別又造成了反應速率的不同。
2、化學反應速率
(1)概念:
單位時間內反應物的減小量或生成物的增加量可以表示反應的快慢,即反應的速率,用符號v表示。
(2)表達式:v=△c/△t
(3)特點
對某一具體反應,用不同物質表示化學反應速率時所得的數值可能不同,但各物質表示的化學反應速率之比等于化學方程式中各物質的系數之比。
3、濃度對反應速率的影響
(1)反應速率常數(K)
反應速率常數(K)表示單位濃度下的化學反應速率,通常,反應速率常數越大,反應進行得越快。反應速率常數與濃度無關,受溫度、催化劑、固體表面性質等因素的影響。
(2)濃度對反應速率的影響
增大反應物濃度,正反應速率增大,減小反應物濃度,正反應速率減小。
增大生成物濃度,逆反應速率增大,減小生成物濃度,逆反應速率減小。
(3)壓強對反應速率的影響
壓強只影響氣體,對只涉及固體、液體的反應,壓強的改變對反應速率幾乎無影響。
壓強對反應速率的影響,實際上是濃度對反應速率的影響,因為壓強的改變是通過改變容器容積引起的。壓縮容器容積,氣體壓強增大,氣體物質的濃度都增大,正、逆反應速率都增加;增大容器容積,氣體壓強減小;氣體物質的濃度都減小,正、逆反應速率都減小。
4、溫度對化學反應速率的影響
(1)經驗公式
阿倫尼烏斯總結出了反應速率常數與溫度之間關系的經驗公式:
式中A為比例系數,e為自然對數的底,R為摩爾氣體常數量,Ea為活化能。
由公式知,當Ea>0時,升高溫度,反應速率常數增大,化學反應速率也隨之增大。可知,溫度對化學反應速率的影響與活化能有關。
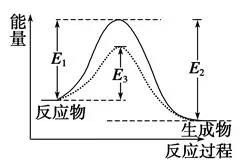
(2)活化能Ea。
活化能Ea是活化分子的平均能量與反應物分子平均能量之差。不同反應的活化能不同,有的相差很大。活化能 Ea值越大,改變溫度對反應速率的影響越大。
5、催化劑對化學反應速率的影響
(1)催化劑對化學反應速率影響的規律:
催化劑大多能加快反應速率,原因是催化劑能通過參加反應,改變反應歷程,降低反應的活化能來有效提高反應速率。
(2)催化劑的特點:
催化劑能加快反應速率而在反應前后本身的質量和化學性質不變。
催化劑具有選擇性。
催化劑不能改變化學反應的平衡常數,不引起化學平衡的移動,不能改變平衡轉化率。
1、物理性質:無色有特殊氣味的液體,密度比水小,有毒,不溶于水,易溶于有機溶劑,本身也是良好的有機溶劑。
2、苯的結構:C6H6(正六邊形平面結構)苯分子里6個C原子之間的鍵完全相同,碳碳鍵鍵能大于碳碳單鍵鍵能小于碳碳單鍵鍵能的2倍,鍵長介于碳碳單鍵鍵長和雙鍵鍵長之間鍵角120°。
3、化學性質
(1)氧化反應 2 C6H6+15O2 = 12CO2+6H2O (火焰明亮,冒濃煙)不能使酸性高錳酸鉀褪色。
(2)取代反應
① 鐵粉的作用:與溴反應生成溴化鐵做催化劑;溴苯無色密度比水大
② 苯與硝酸(用HONO2表示)發生取代反應,生成無色、不溶于水、密度大于水、有毒的油狀液體——硝基苯。+HONO2 +H2O反應用水浴加熱,控制溫度在50—60℃,濃硫酸做催化劑和脫水劑。
(3)加成反應
用鎳做催化劑,苯與氫發生加成反應,生成環己烷+3H2
乙醇CH3CH2OH
1、物理性質:無色有特殊香味的液體,密度比水小,與水以任意比互溶如何檢驗乙醇中是否含有水:加無水硫酸銅;如何得到無水乙醇:加生石灰,蒸餾
2、結構:CH3CH2OH(含有官能團:羥基)
3、化學性質
(1) 乙醇與金屬鈉的反應:2 CH3CH2OH +2Na= 2CH3CH2ONa+H2↑(取代反應)
(2) 乙醇的氧化反應
①乙醇的燃燒:CH3CH2OH +3O2= 2CO2+3H2O
②乙醇的催化氧化反應2 CH3CH2OH +O2= 2CH3CHO+2H2O
CH3CH2OH
乙酸(俗名:醋酸)CH3COOH
1、物理性質:常溫下為無色有強烈刺激性氣味的液體,易結成冰一樣的晶體,所以純凈的乙酸又叫冰醋酸,與水、酒精以任意比互溶
2、結構:CH3COOH(含羧基,可以看作由羰基和羥基組成)
3、乙酸的重要化學性質
(1) 乙酸的酸性:
②乙酸能與碳酸鹽反應,生成二氧化碳氣體利用乙酸的酸性,可以用乙酸來除去水垢(主要成分是CaCO3):2CH3COOH+CaCO3=(CH3COO)2Ca+H2O+CO2↑乙酸還可以與碳酸鈉反應,也能生成二氧化碳氣體:2CH3COOH+Na2CO3= 2CH3COONa+H2O+CO2↑上述兩個反應都可以證明乙酸的酸性比碳酸的酸性強。
(2) 乙酸的酯化反應
(酸脫羥基,醇脫氫,酯化反應屬于取代反應)
乙酸與乙醇反應的主要產物乙酸乙酯是一種無色、有香味、密度比水的小、不溶于水的油狀液體。在實驗時用飽和碳酸鈉吸收,目的是為了吸收揮發出的乙醇和乙酸,降低乙酸乙酯的溶解度;反應時要用冰醋酸和無水乙醇,濃硫酸做催化劑和吸水劑要
現代儀器
1. 核磁共振儀:有機物中處于不同化學環境的氫原子種類;
2. 紅外光譜儀:主要測定有機物中官能團的種類;
3. 紫外光譜儀:有機物中的共軛結構(主要指苯環);
4. 質譜儀:有機物的相對分子質量,對測定結構也有一定的幫助;
5. 原子吸收(發射)光譜儀:測定物質的的金屬元素,也可測定非金屬元素;
6. 分光光度計:測定溶液中物質的成分以含量,重點是測反應速率;
7. 色譜分析儀:利用不同物質在固定相和流動相中分配比的不同,對物質進行分離,主要分類物理性質和化學性質相近的物質,紙層析就是其中的一種;
8. 李比希燃燒法:測定有機物中C、H、O、N、Cl的有無及含量,CO2、H2O、N2、HCl;
9. 銅絲燃燒法:測定有機物中是否含鹵素,火焰為綠色說明含有鹵素;
10. 鈉熔法:測定有機物是否含有X、N、S,NaX、Na2S、NaCN;
11. 元素分析儀:測定物質中元素的種類;
12. 掃面隧道顯微鏡:觀察、操縱物質表面的原子和分子;
基于是過來人,給你說說。一個好的化學老師是可以讓你事半功倍的。平時,要多記,每種元素的各種存在形式,及其物理、化學性質都要記住,有時做題遇到新的東西也要記住它,各種物質之間的轉化關系,轉化條件都要有數,經常舉一反三,比如鐵三角,上課聽到氧化亞鐵,老師不說,你也要在心里默想下怎么變成氧化鐵、四氧化三鐵,還要知道四氧化三鐵是黑色有磁性的,等等。聽說過鐵酸亞鐵嗎 教科書上沒有,但我在題目中遇到過一次,我高考結束后再也沒碰過化學什么的東西,我今年大三,但我至今都記得這物質。化學其實不難,用心學,剛開始肚里沒什么貨,那就勤快點,好好積累知識。化學反應要熟練知道方程式,不過教你個方法,可以不要死記,有些簡單的反應,方程式系數可以不去管它,但你必須好好學習方程式的配平,一定要熟練,這樣你才能寫出最終的化學方程等式。經常看看你以前做過的題目,特別是錯的,好好分析,多問、多思、多練!加油吧,別放棄,有心學習是好事!
高二化學知識點總結相關文章:
高二化學知識點歸納
上一篇:2020高中化學學習方法總結
下一篇:高二化學知識點總結必修四第二章